肿瘤专题 2018年34卷14期
黄玉胜1,吴亚从2,宋一雪2,叶金科2,吴铁鹰2△(1.重庆医科大学附属第二医院肿瘤中心,重庆400010;2.解放军264医院肿瘤中心,山西太原030001)

【摘 要】目的研究肠内营养支持治疗对食管癌同步放化疗患者营养状况和免疫功能的影响。方法选取2014年1月至2016年1月在解放军264医院肿瘤中心接受同步放化疗的经NRS2002评估表进行筛查的具有营养不良风险的患者50例,将其随机分为肠内营养组和对照组,各25例。肠内营养组在治疗期间给予肠内营养支持,对照组常规饮食。比较两组治疗前后体能状态、营养指标、免疫功能的变化及不良反应发生情况。结果肠内营养组放疗后Karnofsky评分(KPS)、体重指数(BMI)、血红蛋白、清蛋白水平与治疗前比较,差异均无统计学意义(P>0.05);对照组KPS评分、BMI、血红蛋白、清蛋白均显著低于治疗前,差异均有统计学意义(P<0.05)。治疗后肠内营养组CD4+、CD4+/CD8+水平均显著高于对照组,差异均有统计学意义(P<0.05)。肠内营养组血液系统不良反应、放射性食管炎发生率均较对照组低,差异均有统计学意义(P<0.05),而两组胃肠道反应比较,差异无统计学意义(P>0.05)。结论食管癌同步放化疗期间积极给予肠内营养支持能有效改善患者的营养状况,增强机体免疫力,提高对放化疗的耐受性,应引起足够的重视。
【关键词】肠内营养; 食管肿瘤; 同步放化疗; 免疫
食管癌是常见的消化道恶性肿瘤。由于食管癌早期缺乏典型的临床症状,大多数食管癌患者确诊时已失去手术机会,只能采取保守治疗的方式。同步放、化疗是治疗中、晚期食管癌的有效方式[1]。但由于同步放、化疗不良反应大,加之食管癌患者吞咽困难及肿瘤消耗,在放化疗期间营养不良发生率高。营养不良不仅影响治疗疗效及进程,还降低了患者的抵抗力,加重了不良反应[2]。因此,对这些患者进行营养支持治疗显得尤为重要[3]。肠内营养作为一种经济、安全、有效的营养支持方法,能够给患者提供必要的能量物质,改善其营养状况[4]。恶性肿瘤患者除了常伴有营养不良外还常伴有免疫功能抑制。近年来,临床研究热点已从肿瘤营养支持发展为免疫营养治疗,免疫营养是指通过某些特殊的免疫营养物质,例如:目前研究及临床应用较多的谷氨酰胺(Gln)、ω-3多不饱和脂肪酸(ω-3PUFAs)、精氨酸(Arg)等来预防和纠正肿瘤患者的营养不良,并且发挥调节机体免疫机制,刺激免疫细胞,增强免疫应答,减轻炎性反应,维护肠黏膜屏障功能的一类营养治疗手段[5?6]。解放军264医院肿瘤中心在食管癌患者放、化疗的同时给予肠内免疫营养支持治疗,能有效改善患者的营养状况,增强机体免疫力提高对放化疗的耐受性,对提高患者的生活质量具有积极作用。现将结果报道如下。
1.1 一般资料 选取解放军264医院肿瘤中心2014年1月至2016年1月收治的50例非手术食管癌同步放化疗患者作为研究对象。纳入标准:(1)经病理确诊的中、晚期食管癌患者,不能或不宜进行手术者;(2)初诊初治,血尿常规、肝肾功能无明显异常;(3)治疗前Karnofsky评分(KPS)≥70分,预计生存期大于或等于3个月,无放化疗禁忌证,拟行同步放化疗;(4)NRS2002评分大于或等于3分;(5)能够配合治疗,理解治疗的不良反应。排除标准:(1)有放化疗禁忌证;(2)有严重心脑血管疾病、肝肾疾病;(3)严重营养不良者。其中颈段及胸上段食管癌23例,胸中段食管癌15例,胸下段食管癌12例;Ⅱ期17例,Ⅲ期28例,Ⅳ期5例;腺癌8例,鳞癌39例,小细胞癌3例。50例患者采用随机数字分组法分成肠内营养组和对照组,各25例。肠内营养组中男 21例,女 4例;平均年龄(62.16±6.10)岁;对照组中男 23例,女 2例,平均年龄(63.08±7.01)岁。两组一般资料比较,差异无统计学意义(P>0.05),见表1。该研究通过解放军264医院伦理委员会批准。所有患者及家属均享有知情权,自愿参加本研究并签署知情同意书。
1.2 方法
1.2.1 同步放化疗 两组患者均采用调强放疗(IMRT)。患者采用CT模拟机定位,扫描层厚5 mm。靶区的勾画需要2位临床医师一起进行,肿瘤靶区(GTV)包括食管壁增厚大于或等于0.5 cm的肿瘤,食管旁、食管气管旁沟、心包角短径大于或等于0.5 cm和纵隔短径大于或等于1.0 cm转移淋巴结;临床靶区(CTV)包括原发病灶及其前后左右0.5~0.8 cm,上3.0 cm,下4.0 cm的组织。计划靶区(PTV)在CTV基础上左右外扩0.5 cm,上下:颈段、胸上段外扩0.5 cm,胸中下段外扩0.8~1.0 cm。95%GTV总剂量60 Gy,每次2.0 Gy,95%CTV总剂量54 Gy,每次1.8 Gy,每周 5次,共30次,6周。脊髓最大剂量小于或等于 45 Gy,双肺 V20≤28%,心脏 V40≤40%。于放疗第1天开始同步化疗,化疗采用顺铂联合氟尿嘧啶方案:顺铂75mg/m2,第1天;氟尿嘧啶1000mg/m2,第1~4天,28 d为1个周期。化疗期间给予止吐、保护胃肠黏膜、保肝等对症治疗。放化疗期间每周复查血常规1~2次,第2周期化疗前复查肝肾功能。
1.2.2 营养支持 肠内营养组除常规饮食外,于放化疗开始同时给予肠内营养支持,根据体重按照每天35 kcal/kg的热量供给,在进食不足的基础上给予口服肠内营养液(瑞能华瑞公司)补足。肠内营养液每100毫升含热量 546 kJ、糖类 10.4 g、蛋白质 5.85 g、Arg0.23 g、脂肪7.2 g、ω-3PUFAS0.3 g、核苷酸 0.13 g、膳食纤维 1.3 g 及各种微量元素、矿物质和维生素等。对照组在放化疗期间常规饮食。治疗后期由于放化疗不良反应,患者进食减少,两组均增加肠外营养支持:给予10%葡萄糖注射液及20%脂肪乳静脉滴注。
1.2.3 观察指标 临床医生分别于同步放化疗前1 d和同步放化疗结束后1 d评估患者一般状况,测量身高、体重,同时抽取外周血检测各营养指标和免疫相关指标。(1)KPS评分,总分为100分,分值越高表明健康情况越好。(2)营养状况:包括体重指数(BMI)、血红蛋白、清蛋白。(3)免疫功能:血液中 CD4+、CD8+、CD4+/CD8+T淋巴细胞,采用流式细胞仪分析法测定。在治疗过程中密切观察患者不良反应情况,随访血液毒性及胃肠道反应:采用WHO分级标准;急性放射性反应:采用放射治疗协作标准(RTOG);食管穿孔:采用上食管吞钡造影确诊。
表1 两组患者临床资料比较

注:?表示无此项
1.3 统计学处理 应用SPSS21.0统计软件分析数据。计数资料以 ±s表示,采用t检验。计数资料以率或构成比表示,采用χ2检验。P<0.05为差异有统计学意义。
±s表示,采用t检验。计数资料以率或构成比表示,采用χ2检验。P<0.05为差异有统计学意义。
2.1 KPS评分变化 治疗前本研究排除了KPS评分小于70分的患者,治疗前肠内营养组和对照组KPS评分分别为(82.40±8.31)、(83.20±9.00)分,两组比较,差异无统计学意义(P=0.148)。同步放化疗后肠内营养组和对照组KPS评分[(79.20±7.02)、(70.80±7.59)分]均较治疗前降低。肠内营养组同步放化疗后KPS评分较治疗前有所降低,但差异无统计学意义(P>0.05)。对照组同步放化疗后KPS评分较治疗前明显降低,差异有统计学意义(P<0.05)。
2.2 营养指标变化 治疗前两组BMI、血红蛋白、清蛋白水平比较,差异均无统计学意义(P>0.05)。肠内营养组同步放化疗前后各营养指标比较,差异无统计学意义(P>0.05)。对照组同步放化疗后BMI、血红蛋白和清蛋白水平均显著低于对照组治疗前和肠内营养组治疗后水平,差异均有统计学意义(P<0.05)。见表2。
表2 两组患者治疗前后营养指标比较( ±s)
±s)
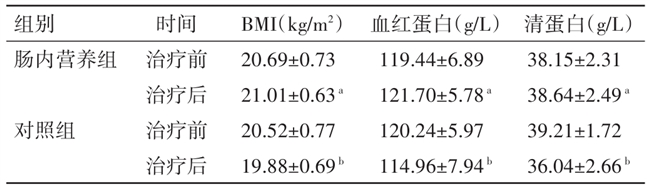
注:与对照组治疗后比较,aP<0.05;与对照组治疗前比较,bP<0.05
2.3 免疫功能变化 治疗前两组 CD4+、CD8+、CD4+/CD8+比较,差异均无统计学意义(P>0.05)。肠内营养组同步放化疗前后各免疫功能指标比较,差异无统计学意义(P>0.05)。对照组同步放化疗后免疫功能指标CD4+、CD4+/CD8+均显著低于该组治疗前及肠内营养组治疗后水平,差异均有统计学意义(P<0.05),而两组CD8+比较,差异无统计学意义(P>0.05)。见表3。
表3 两组患者治疗前后免疫指标变化( ±s)
±s)
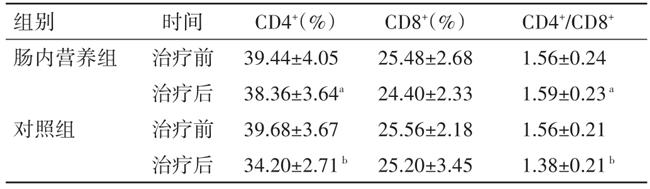
注:与对照组治疗后比较,aP<0.05;与对照组治疗前比较,bP<0.05
2.4 两组不良反应发生情况比较 肠内营养组血液系统不良反应、放射性食管炎发生率均较对照组低,差异均有统计学意义(P<0.05)。两组胃肠道反应比较,差异无统计学意义(P>0.05)。两组患者无一例食管穿孔发生。见表4。
表4 两组患者治疗前后不良反应发生情况比较(n)

注:?表示无此项
我国是世界上食管癌高发地区之一,其发病率位于我国恶性肿瘤第5位,每年平均病死人数约15万例。早期食管癌缺乏典型临床症状,70%~80%的食管癌患者确诊时已经失去手术的机会[7]。同步放化疗目前是不能手术或拒绝手术治疗的食管癌患者的首选治疗方案[8],其除了最大限度地发挥化疗和放疗的抗肿瘤协同效用外,还可以预防肿瘤细胞耐药基因的表达。由于多种原因食管癌患者易发生营养不良,大量研究表明,食管癌营养不良发生率为40%~80%[9?10]。食管癌患者营养不良主要与以下因素有关:(1)肿瘤细胞生长所致的机械性梗阻,食管癌患者进行性吞咽困难,导致摄入减少;肿瘤生长致营养消耗增加;(2)肿瘤可分泌特殊的细胞因子,导致患者厌食或食欲减退;(3)肿瘤可分泌特殊的促炎性因子等导致患者脂肪、蛋白质等分解代谢增加;(4)手术创伤和应激所引起的高分解代谢又加剧了营养不良[11];(5)患者对营养知识的缺乏及放化疗导致放射性食管炎、恶心、呕吐等消化道症状。在食管癌患者放疗过程中,由于食管黏膜受损,平滑肌皱襞萎缩,黏膜下组织发生纤维化,患者吞咽困难加重,从而影响食欲及进食能力,营养不良发生率较高。对于化疗患者,尤其以顺铂为基础的联合化疗患者,一般都有明显的恶心、呕吐、食欲下降等胃肠道不良反应;同时化疗药物多在肝脏代谢,可能出现肝脏损伤,肝脏合成功能下降,从而影响营养状况。同步放化疗的不良反应较单纯放疗或化疗更重,所以对患者进食的影响会更明显。营养状况不仅与抗肿瘤治疗的耐受性相关,还会加大放疗摆位误差,影响放疗精确度,降低放疗敏感性,从而直接影响患者的治疗效果及生存期[12]。同时营养不良还会导致患者住院时间延长,有些患者因此而中断治疗。因此,对肿瘤患者实施营养支持治疗可改善患者的营养状况,对于保证治疗的疗效、降低治疗并发症发生率、提高患者的生活质量具有积极意义[13]。
本研究在充分评价患者营养状况的基础上再给予有效的同步放化疗抗肿瘤治疗的同时给予肠内营养支持治疗。研究表明,肠道黏膜的营养30%来自肠系膜动脉血液的供应,70%来自于肠腔内营养物质。因此,对于营养不良患者给予肠内营养支持对于维护小肠功能具有重要意义[14]。肿瘤性营养不良不同于单纯饥饿所导致的营养不良,恶性肿瘤患者的营养不良表现为系统性炎性反应、胰岛素抵抗、分解代谢亢进等,且以蛋白质分解、肌肉丢失为主[15?16]。本研究结果显示,肠内营养组患者BMI、血红蛋白、血清清蛋白水平在放化疗后无未出现明显下降,而对照组下降较明显,提示肠内营养支持能有效改善食管癌患者的营养状况。由于肠内营养组患者各营养指标在同步放化疗后未出现明显降低,因而该组患者KPS评分与治疗前无明显差异,这也为患者顺利完成治疗提供了良好的体力基础。肠内营养符合人体生理需要,有利于肝脏蛋白质的合成和代谢,能较好地补充谷氨酰胺和纤维素,有利于消化道黏膜结构和功能的恢复和维持。因此,本研究中肠内营养组放射性食管炎的发生率明显低于对照组,使得放化疗能及时完成,从而间接提高放化疗疗效。
肠道是人体免疫系统的重要场所,在机体免疫防御过程中起着重要作用。免疫功能的稳定依赖于辅助性T细胞和抑制性T细胞之间的平衡,CD4+细胞具有促进效应细胞抗肿瘤的作用,CD8+细胞主要起免疫抑制作用,CD4+/CD8+比值能反映二者之间的平衡,可作为衡量恶性肿瘤患者免疫抑制程度的重要指标,低CD4+、CD4+/CD8+水平对机体免疫状态不利[17]。研究表明,长期肠外营养使 CD3+、CD4+、CD8+及 CD4+/CD8+显著降低[18]。肿瘤患者机体处于免疫抑制状态,加之同步放化疗具有明显的血液学毒性,加重了患者的免疫抑制状态,因而能刺激免疫细胞,增强免疫应答,维护肠黏膜屏障功能的肠内免疫营养治疗成了大家关注的焦点。ω-3PUFAs能不仅能供给能量,还能抗肿瘤、增强免疫功能及抑制炎性反应,因而在肠内营养中添加ω-3多不饱和脂肪酸受到了越来越多的重视。ω-3 PUFAs是由多种小分子脂肪酸组成,包括α-亚麻酸(ALA)、二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)。ALA主要来源于植物油,EPA和DHA存在于深海冷水鱼类海藻中。滕向龙等[19]研究发现,术后应用ω-3PUFAs制剂能够使试验组CD3+、CD4+、CD4+/CD8+水平均明显高于对照组。李世伟等[20]的研究也表明ω-3 PUFAs可以改善结直肠癌根治术后患者的免疫状态,说明肠内营养能促进T淋巴细胞亚群CD3+、CD4+、CD8+的生成,继而提高术后患者的免疫功能。肠内营养符合生理状态,能较好地保护其免疫功能、纠正放疗引起的淋巴细胞免疫抑制,促进其功能恢复,而含有ω-3多PUFAs的肠内营养剂是肿瘤患者理想的营养支持手段。本研究结果显示,对照组治疗后免疫功能指标CD4+、CD4+/CD8+水平均显著低于治疗前,而肠内营养组治疗前后各免疫功能指标比较,差异无统计学意义(P>0.05)。有力地表明富含ω-3PUFAs的肠内营养支持能通过免疫应答,促进CD4+、CD8+T淋巴细胞增殖,提高机体的免疫功能,增强机体的免疫系统作用。
地址:重庆市渝北区宝环路420号重庆市卫生健康统计信息中心5楼《现代医药卫生》杂志 邮编:401120
电话:023-63853583、63621701 电子邮箱:xdyyws@vip.126.com、xdyyws@126.com