肠道微生态与疾病专题 2019年35卷1期

肠道菌群主要存在于下消化道结肠和直肠中,尤其以下消化道与肠道菌群的关系最为密切,几乎所有的消化道疾病均与肠道菌群有联系。近年来,越来越多的研究关注到肠道菌群与药物的相互作用在消化系统疾病治疗中的影响,消化系统常用药物大致包括质子泵抑制剂(PPIs)、抗菌药物、非甾体抗炎药物(NSAIDs)、脂肪肝降脂药物和抗癌药物等。
药物代谢和疗效不仅取决于机体本身,还取决于存在于宿主胃肠道的微生态系统。肠道是药物吸收的主要场所,肠道菌群直接或间接影响各种药物的代谢,同时,药物也会影响肠道菌群的组成和功能,两者形成了一种潜在的相互作用机制。更有研究者给这种机制赋予了一个新的术语——药物微生物组学。研究表明,人体肠道内存在着以还原和水解反应为主,氧化、羟基化、脱羟化、脱烷基化、脱氨、脱乙酰化、乙酰化、脱乙酰化等反应类型为辅的多样性生物转化反应。而生物转化反应以微生物酶催化的形式,通过激活、失活和调节药物代谢,直接改变药物的功效和毒性。肠道微生物也可以通过改变宿主代谢、产生与药物受体竞争的代谢物来间接控制药物的功效和毒性。而肠道菌群的组成可以根据摄入药物的数量和组合产生变化。药物诱导的肠道菌群变化可能改变药物伴随的药代动力学。研究表明,与非服药患者比较,长期服用单一药物患者的菌群组成存在显著差异。因此,肠道药物-菌群相互作用对消化系统疾病的治疗至关重要。
1.1 PPIs PPIs是阻碍胃壁细胞H+-K+-三磷酸腺苷(ATP)酶而抑制胃酸分泌的抗溃疡药物,是治疗消化系统疾病的常用药物,被广泛用于消化性溃疡、胃食管反流病、上消化道出血和根除幽门螺杆菌等。研究证实,PPIs的长期使用可以改变肠道菌群的组成[1],并可能增加艰难梭状芽孢杆菌和弯曲杆菌的数量[2-3],甚至会提高小肠细菌过度生长的发生率[4]。有机酸是维持肠道pH值和肠道动力、为肠上皮细胞提供能量的重要成分,肠道菌群的变化会影响有机酸的代谢,进一步加重对肠道的破坏。
奥美拉唑(OME)是一种高效抑制胃酸分泌的PPIs。OME能够改变胃肠道pH值和胃排空率,直接影响肠道菌群和肠道病原体的存活[5]。IMHANN等[6]证实,使用OME后肠道菌群α多样性显著降低,细菌类群比使用前改变20%。REVELES等[5]在一项对照研究中得出结论:在使用OME 14 d后,肠道中放线菌门和毛螺菌科、红衫木菌科、双歧杆菌科的数量显著降低,链球菌科的数量显著增多。
1.2 抗菌药物 抗菌药物能干扰人的各种生理功能,也会引起肠道菌群失衡。定植在人类肠道中的菌群种类及其分布是发挥人体正常生理功能和维持健康的重要因素。大多数肠道菌群对人体无害,人体的肠道也存在抵御病原菌的保护屏障,但抗菌药物的使用会改变健康的肠道菌群环境,临床中使用抗菌药物所形成的耐药基因在人体肠道菌群中也广泛传播,导致耐药菌的出现,降低抗菌药物的疗效。
表1抗菌药物对肠道菌群的影响
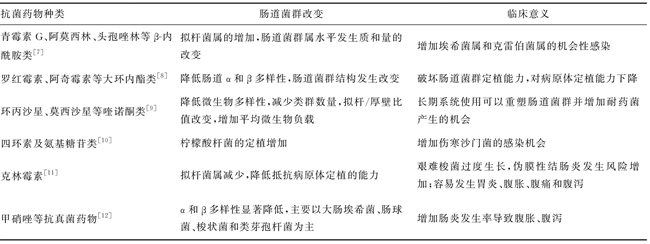
目前,抗菌药物的滥用已经成为肠道菌群失调的重要因素。抗菌药物对肠道菌群的影响主要在于其抗菌谱、给药途径、给药剂量和肠道内药物水平。β-内酰胺类药物经胆管排泄,在肠道内水平较高,对肠道菌群的影响显著。克林霉素也是通过胆汁排泄,亦对肠道菌群影响较显著。喹诺酮类对厌氧菌作用小,氨基糖苷类口服给药影响大但肠外给药影响较小。表1中列举出各类抗菌药物对肠道菌群的影响及临床意义。
抗菌药物还通过影响菌群的代谢能力,破坏肠道定植能力。抗菌药物可能通过影响肠道的组成,进而破坏整个肠道的微生物代谢环境、微生态系统与宿主之间的相互作用,改变致菌群在肠道的定植能力。肠道菌群改变及菌群定植能力破坏可能促进疾病的发生、发展,甚至延缓疾病的康复进程。
1.3 NSAIDs NSAIDs是一类通过抑制前列腺素合成而发挥解热、镇痛和抗炎性作用的药物。在临床上广泛应用于骨关节炎、类风湿关节炎、发热、疼痛等疾病,但其可导致严重的并发症和胃肠道病变,甚至出现溃疡、出血和穿孔。因此,NSAIDs与胃肠道疾病的关系非常密切,NSAIDs对肠道菌群的影响、肠道菌群对NSAIDs药代动力学和疗效影响的相关研究成为热门领域。
阿司匹林为应用最早、最广泛和最普通的解热镇痛抗炎药物。ROGERS等[13]通过一项随机对照研究发现,服用阿司匹林的患者肠道内拟杆菌属和肠杆菌科、氨基酸球菌科的数量比不服用的对照组更多,而服用塞来昔布和布洛芬患者也有相似的结果。然而,丙酸杆菌科、假单胞菌科、紫红球菌科和理研菌科等菌科在服用布洛芬患者肠道中比服用萘普生、酮咯酸患者或对照组患者肠道中更丰富。在服用布洛芬患者肠道中最受影响的是普氏菌属和另枝菌属,而在服用萘普生患者的肠道中最受影响的是拟杆菌属。同时,该研究还发现,在服用抗菌药物和H2受体抑制剂患者肠道中拟杆菌属最丰富,并且NSAIDs合并PPIs使用的患者肠道菌群与NSAIDs不合并PPIs使用的患者不同。这些结果均提示,肠道菌群可能反映人们用药的类型,使用NSAIDs的患者呈现与不使用者不同的肠道菌群;不同的NSAIDs种类还呈现出不同的肠道菌群类型。
不同NSAIDs对肠道菌群的影响各异,肠道菌群又会反作用影响NSAIDs的代谢。CRACIUN等[14]发现,脱硫弧菌、梭状芽胞杆菌、链球菌、克雷伯菌和变形杆菌等厌氧菌可以产三甲胺(TMA)和氧化三甲胺(TMAO)代谢胆碱,从而降低心血管病发生风险,而使用萘普生后患者心血管风险会增加,正是因为菌群代谢胆碱被萘普生抑制。KIM等[15]通过研究证实,抑制肠道菌群的代谢活性可以增强阿司匹林的抗血栓效果。
1.4 脂肪肝降血脂药物 降血脂药物是能够降低血浆中性脂肪(胆固醇、三酰甘油)和类脂(脂、磷脂、固醇和类固醇)水平的药物,主要包括他汀类、贝特类、烟酸类、胆酸螯合剂和胆固醇吸收抑制剂。某些降血脂药物口服后经肠道吸收,在肝脏代谢然后经胆汁分泌进入肠道中,有研究也证实,患者服用降血脂药物后肠道菌群发生了改变。CATRY等[16]发现,使用依泽替米贝不改变肠道菌群的总数量,但乳酸杆菌属数量会显著减少。CAPARROS-MARTIN等[17]给予高脂血症老鼠他汀类药物治疗,发现治疗后以拟杆菌目S24.7.为主的拟杆菌属增加,也可致毛螺菌科、梭菌科和疣微菌科增加。
1.5 抗结直肠癌药物 结直肠癌是最常见的消化道恶性肿瘤,也是世界上第三高发恶性肿瘤,已严重威胁到人类的健康。结直肠癌的发病机制目前仍不十分清楚,但大量研究表明,菌群的种类、数量及其代谢产物的改变在结直肠癌的发生、发展中可能发挥重要的作用。某些研究发现,结直肠癌组织的细菌多样性表现出显著下降,表现为柔嫩梭菌属的数量显著降低,梭杆菌和罗氏菌属等梭状芽胞杆菌的成员数量增加[18]。肠道菌群对抗结直肠癌治疗药物代谢动力学的影响及其疗效尚不清楚,也成为一个不断扩大探索的研究领域。许多抗癌疗法依赖于调节患者的免疫和炎性反应[19]。然而,肠道菌群可以通过黏膜和全身水平等多种因素影响这些过程[20]。
盐酸伊立替康(CPT-11)是一种抑制Ⅰ型DNA拓扑异构酶而阻碍DNA合成的抗肿瘤药物,该药物用于治疗转移性结肠或直肠癌。研究发现,该药物的疗效和不良反应可以被肠道菌群改变[21]。CPT-11在肠道内可经β-葡萄糖醛酸酶代谢变成其活性代谢物SNL-38,后者通过破坏盲肠的隐窝细胞引起黏膜下炎性反映进而导致严重腹泻,而肠道中大肠杆菌、葡萄球菌属和梭菌属可产生β-葡萄糖醛酸酶而增加其不良反应[22]。有研究发现,CPT-11可以增加这些细菌在结肠中的定植,进一步加重病情[23]。因此,使用CPT-11治疗时可通过降低肠道菌群多样性或同时服用β-葡萄糖醛酸酶选择性抑制剂来降低其不良反应的发生。
5-氟尿嘧啶(5-FU)是在细胞内转化为有效的氟尿嘧啶脱氧核苷酸后,干扰DNA合成的抗代谢药物,对消化道癌及其他实体瘤具有良好疗效。然而,5-FU的抗癌疗效受到肠道菌群的调节。近年一项研究表明,乳酸杆菌可以增强5-FU的抗结肠癌效果并且通过抑制结肠癌细胞中Wnt/β-catenin信号通路,减少结肠癌细胞的抗药性,但5-FU可致肠道中的乳酸杆菌减少[24]。另有研究提示,肠道中的大肠杆菌可将5-FU进行活性生物转化,而过多的大肠杆菌可使患者体内过多的5-FU暴露而致黏膜炎和神经病变等不良反应产生[8]。
环磷酰胺(CTX)是在人体内被肝脏等代谢变为磷酰胺氮芥而起活化作用的氮芥类衍生物。有研究表明,使用CTX后会出现肠绒毛的减少和变短、肠道黏膜屏障的破坏,尽管在使用药物7 d后肠道菌群的总体数量没有改变,但是会导致乳酸杆菌和肠球菌的数量减少,分段丝状菌、约氏乳杆菌、鼠李杆菌和海氏肠球菌等革兰阳性菌对CTX引起的Th17细胞和Th1细胞的聚集具有重要调节作用[25]。
大量口服药物的疗效正面临着许多挑战,其中包括药物在胃肠道中的稳定性,给予药物包衣等方式能够有效避免药物在胃酸作用下的降解。过去认为,当药物到达肠道中很快就会被小肠吸收而几乎不与肠道菌群相互作用。然而,最近的研究表明,肠道菌群可改变药物在肠道中的生物转化过程。尤其某些在肠道中有较低溶解性和渗透性的合成药物,其在胃肠道的时间较长,也创造了更多与肠道菌群相互作用的机制[26]。因此,有必要考虑肠道菌群对药物代谢的改变和对药代动力学、药效的影响。表2列举了部分肠道菌群对药物代谢的影响及临床意义。
表2肠道菌群对部分药物的影响及临床意义

注:-表示无此项
肠道菌群是人体内的复杂微生态系统,对维持人体的不同生理功能具有重要的作用,通过分析肠道菌群可以了解人体的健康状态。维持肠道菌群的稳态,有助于人类身体健康。“粪菌移植”(FMT)是将健康人的肠道菌群移植到患者肠道的一种有效治疗手段,是一种重新建立肠道微生物稳态的高效方法。目前,该技术能够成功治疗万古霉素难以治疗的艰难梭菌感染,美国及欧洲国家已经就FMT治疗艰难梭菌感染的临床实践达成共识。随着肠道疾病的发病率逐年增高,FMT疗法也被用于多种肠道疾病的治疗,包括炎性肠病、慢性腹泻等,并获得很好的治疗效果。FMT可能会发挥调节药物与肠道菌群的相互作用,从而起到促进药物疗效,减少药物损伤的作用。从药物微生物组学的视角深入研究其相互关系和影响,对合理用药、提高药物疗效、认识药物新的作用机制和新药研发等均具有重要价值。
[1]JACKSON MA,GOODRICH JK,MAXAN M,et al.Proton pump inhibitors alter the composition of the gut microbiota[J].Gut,2016,65(5):749-756.
[2]NAITO Y,KASHIWAGI K,TAKAGI T,et al.Intestinal dysbiosis secondary to Proton-Pump inhibitor use[J].Digestion,2018,97(2):195-204.
[3]FREEDBERG DE,LEBWOHL B,ABRAMS JA.The impact of proton pump inhibitors on the human gastrointestinal microbiome[J].Clin Lab Med,2014,34(4):771.
[4]LOMBARDO L,FOTI M,RUGGIA O,et al.Increased incidence of small intestinal bacterial overgrowth during proton pump inhibitor therapy[J].Clin Gastroenterol Hepatol,2010,8(6):504-508.
[5]REVELES KR,RYAN CN,CHAN L,et al.Proton pump inhibitor use associated with changes in gut microbiota composition[J].Gut,2018,67(7):1369-1370.
[6]IMHANN F,BONDER MJ,VICH VA,et al.Proton pump inhibitors affect the gut microbiome[J].Gut,2016,65(5):740-748.
[7]PANDA S,KHADER I,CASELLAS F,et al.Short-Term effect of antibiotics on human gut microbiota[J].PLoS One,2014,9(4):e95476.
[8]WILKINSON EM,ILHAN ZE,HERBST-KRALOVETZ MM.Microbiota-drug interactions:Impact on metabolism and efficacy of therapeutics[J].Maturitas,2018,112(1):53-63.
[9]JERNBERG C,LOFMARK S,EDLUND C,et al.Long-term impacts of antibiotic exposure on the human intestinal microbiota[J].Microbiology,2010,156(11):3216-3223.
[10]BERGSTROM KS,KISSOON-SINGH V,GIBSON D L,et al.Muc2 protects against lethal infectious colitis by disassociating pathogenic and commensal bacteria from the colonic mucosa[J].PL