指南 2019年35卷15期
肝纤维化是存在于大多数慢性肝脏疾病过程中的病理变化,主要表现为肝组织内细胞外基质(ECM)的过度增生与沉积,从而导致肝脏组织结构异常改变,并影响肝脏正常生理功能,其本质是慢性肝病过程中的一种可逆的肝组织损伤过度修复反应,肝纤维化的持续存在,伴随正常肝实质细胞的坏死和凋亡,而ECM不断累积,肝实质逐步被ECM形成的瘢痕组织取代,最终形成肝硬化,甚至门静脉高压或肝癌的发生,导致肝衰竭[1]。
慢性肝病包括肝炎病毒、乙醇、药物与毒物、寄生虫、代谢和遗传、胆汁淤积、免疫异常等病因所致的病程超过半年的各种肝病。因长期病因刺激、异常代谢及免疫炎性反应,可导致肝实质细胞的损伤,启动肝纤维化发生。因此肝纤维化可见于大多数慢性肝脏疾病[2],进一步发展,可形成肝硬化,严重影响患者健康与生命。前瞻性研究表明,慢性乙型肝炎发展为肝硬化的年发生率为2%~10%[3]。因此积极治疗肝纤维化,使之逆转或延缓发展,对提高患者生活质量,改善疾病预后,有着十分重要的意义。研究结果显示,西医学的病因治疗有助于抑制甚至逆转肝纤维化,例如长期抗乙型肝炎病毒治疗,可以有效抑制病毒复制,逆转慢性乙型肝炎肝纤维化[4]。但是,针对病因治疗抗肝纤维化取效仍存在一定的局限性,并不能完全抑制炎症,而肝纤维化的机制一旦启动往往呈主动进展,因此针对纤维组织增生与降解的抗肝纤维化治疗十分必要,是慢性肝病的重要治疗措施[5]。对于缺乏针对病因治疗的慢性肝病,抗肝纤维化治疗作用则更为重要。肝硬化是肝纤维化发展的结局,阻止或逆转肝纤维化是其基础治疗手段之一。
由于肝纤维化的病理机制复杂,是肝损伤后的机体整体参与的修复反应,针对单一靶标研发的药物在临床很难奏效,因此目前尚无疗效明确的化学药物或生物药物可供临床应用。中医药是中国各族人民在几千年生产生活实践和与疾病作斗争中逐步形成并不断丰富发展的医学科学,具有完整的理论体系。近数十年的研究和应用实践已经表明,中医药治疗肝病具有疗效,尤其在肝纤维化防治领域显示出疗效优势[6]。一项回顾性研究表明,服用抗肝纤维化中成药扶正化瘀胶囊的肝硬化患者中位生存时间为351.6周,对照组为112.1周,2组5年生存率差异有统计学意义(P=0.000)[7]。虽然中药复方治疗肝纤维化的作用机制尚未完全揭示,但不妨碍临床应用。我国已批准的多个抗肝纤维化中药制剂,在临床广泛应用20多年,已积累大量临床资料,尚未有不良反应的报道。
为了充分认识肝纤维化防治的重要性,为从事肝脏疾病防治的中医、中西医结合临床医师提供指导性意见,本学会组织国内专家,经多次讨论修改,于2006年发布了《肝纤维化中西医结合防治指南》(以下简称指南)[8]。近10年来,国内外有关各种慢性肝病的基础和临床研究取得快速进展,加深了对肝纤维化及其逆转过程的认识,丰富了诊疗手段。为此需对本指南加以更新修订。本指南只是帮助医师对肝纤维化的诊断和治疗作出正确、合理决策,不是强制性标准,也不可能包括或解决肝纤维化诊断和治疗中的所有问题。临床医师在针对某一具体患者时,应充分了解本病的最佳临床证据和现有医疗资源,并在全面考虑患者具体病情及其意愿的基础上,根据自己的知识和经验,制订合理的诊疗方案。由于肝纤维化的研究进展迅速,本指南仍将根据学科进展和临床需要不断更新和完善。
本指南中的证据等级根据GRADE分级修订分为3个级别,推荐等级分为2个级别,见表1。
2.1 西医学机制 参与肝纤维化过程的细胞中,活化的肝星状细胞(HSC)是生成纤维组织的关键细胞。不同的病因刺激可以造成肝脏慢性损伤,肝细胞发生凋亡、坏死或坏死性凋亡,导致肝脏炎症。肝细胞、枯否细胞、肝窦内皮细胞和淋巴细胞可以通过释放细胞内容物、细胞因子和活性氧簇等,刺激位于狄氏间隙内的静止期HSC,使之活化成为肌成纤维细胞,产生大量ECM,形成纤维间隔和肝窦的毛细血管化,造成肝纤维化,并伴有纤维间隔内的血管增生。机体感染血吸虫后,虫卵随血流行止于肝窦入口处形成肉芽肿后发生肝纤维化。肝窦毛细血管化、肌成纤维细胞收缩和虫卵肉芽肿都可致肝窦狭窄、血流阻力增大,是导致门静脉高压的重要病理基础。肝窦微循环障碍会延迟抗病毒T淋巴细胞的募集,从而延缓病毒的清除,最后加重了由抗原持续激活的T细胞造成的组织损伤,成为慢性肝炎迁延不愈的原因之一[9]。淋巴细胞可以激活HSC或促进其凋亡,在肝纤维化形成和消退过程中都可发挥作用[10-11]。慢性肝损伤时自由基的活化导致肝内氧化应激和抗过氧化防御机制效能的降低,参与了组织重构和肝纤维化的发生,该机制在酒精性肝炎和非酒精性脂肪性肝炎时尤其重要。肝内促纤维化的微环境近年来得到关注,可吸引淋巴细胞特别是巨噬细胞的一些亚型调控肝纤维化的形成或消解。此外,肠道微生物的作用、形成厌氧促炎环境的组织缺氧的作用、肝纤维化进展调控的后天修饰的作用和肝纤维化发展过程中组织硬度等也都影响肝纤维化的进展[2,12]。
表1 推荐意见的证据等级和推荐等级

2.2 中医学病因病机 中医学原无此病名记载。根据肝纤维化(包括肝硬化)的病理变化和临床表现,用中医病名概括,多将其归集在“积聚”“胁痛”等。这种认识数十年来在临床得到普遍认同。肝纤维化的原发病因各异,临床表现虽有不同,但是基本病机为正虚邪盛,邪毒久稽,肝络受损,气滞血瘀,可归纳为“虚损生积”。依患者病情不同还可有寒热转化、肝气郁结、脾运失调、湿热内蕴、寒凝积滞等不同病机的临床表现。肝纤维化本质上是肝脏形质损伤,阴精亏损,无以化气为用,以致气血不行,凝血蕴里不散而成积[13]。其中“虚损”主要表现在脾气虚、肝气虚和肝肾阴精虚损等方面,气虚反映了机体功能的损伤与降低,而肝肾阴精虚损则指肝脏形质损伤,是虚损更深层次的病机变化。通过基础研究进一步明确“虚损”主要体现在肝实质细胞数量的减少与功能的衰退以及肝窦壁的损伤,而“血瘀”主要表现为肝脏细胞外基质的过度沉积以及肝窦的毛细血管化等病理改变[14]。
2.3 致肝纤维化的危险因素 对于慢性肝病特别是慢性病毒性肝病患者,大量饮酒、病程较长与年龄较大、体重指数(BMI)增加、胰岛素抵抗、肝细胞脂肪变性、艾滋病病毒感染与药物使用不当等[1-2]是导致或加重肝纤维化的危险因素。
对慢性肝病肝纤维化程度的评估是判断病情、决定治疗、随访疗效、评估预后的关键环节。早期肝纤维化的诊断尤为重要,有益于控制疾病的发展或促进逆转。
3.1 临床表现 肝纤维化患者的临床表现多为原发慢性肝病的临床表现,差异较大。常见的临床表现有:疲倦乏力、食欲不振、大便异常、肝区不适或胀或痛、睡眠障碍、舌质暗红或暗淡、舌下静脉曲张、脉弦细等。肝硬化患者还可有面色晦暗、蜘蛛痣、肝掌、脾脏肿大、舌有瘀斑等体征。部分患者可无明显症状与体征,或可表现为伴同于原发慢性肝病的其他临床表现。
3.2 病理学、影像学和实验室检查 由于肝纤维化的临床表现缺乏特异性,诊断主要依赖于病理学、影像学和实验室检查。迄今为止,肝活体组织病理学检查是不可替代的“金标准”,但属于有创检查,并存在标本及读片者的误差等不足。近年来,影像学等物理学检查技术发展很快,具有无创、简便、快速、易于操作、可重复性、安全性和依从性好的特点,可以在一定程度上弥补组织病理学观察的不足,如将实验室检查的不同指标组合建立的各种诊断纤维化的血清学模型、瞬时弹性成像(TE)、磁共振弹性成像(MRE)等。如果能将多种检查方法组合应用,可望提高肝纤维化诊断的准确率。以下是我国目前临床常用的诊断方法。
3.2.1 肝组织病理学检查 肝组织病理学检查是明确诊断、衡量炎症与纤维化程度,以及判定药物疗效的重要依据。肝活组织检查的基本要求包括:用粗针穿刺(最好用16 G),标本长度最好1.5 cm以上或镜下包括10个以上汇管区,如果标本长度小于1 cm,难以作出明确病理诊断。肝活组织检查标本应做连续切片,常规做苏木精-伊红、Masson三色染色和(或)网状纤维染色。肝脏炎症坏死分级和纤维化程度分期,推荐采用国际上常用的Metavir评分系统[15](见表2、3)。也可参照KNODELL[16]、ISHAK[17]、SCHEUER[18]、CHEVALLIER[19]等评分系统了解肝脏纤维化程度。
一部分肝硬化可以逆转的观点已被临床和组织病理学观察所证实。为了更准确地评估治疗过程中肝硬化病理的动态变化,肝硬化病理分期的进一步细化十分必要[20]。Laennec评分系统根据纤维间隔的宽窄及结节大小,将肝硬化进一步细分为4a(轻度:细小纤维间隔,最多有1个宽大纤维间隔)、4b(中度:至少有2个宽大纤维间隔)及4c(重度:至少有1个显著宽大纤维间隔或多个小结节),该评分系统与肝硬化的临床分期及肝静脉压力梯度具有良好相关性[21],可以预测肝硬化相关终点事件的发生[22]。建议临床参考应用。
表2 肝组织炎症活动度评分(分)
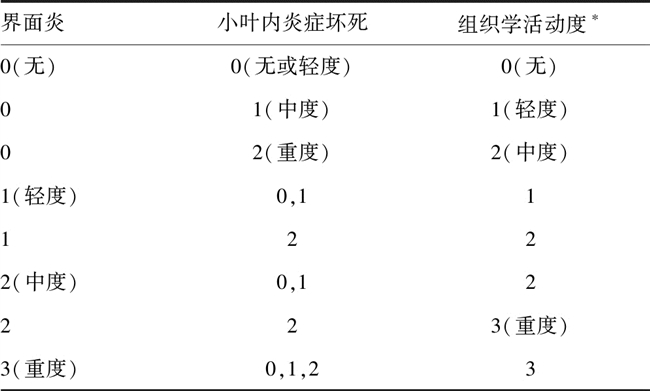
注:*表示根据界面炎和小叶内炎症坏死程度综合确定
表3 肝组织纤维化分期评分(分)

3.2.2 TE TE是近年发展起来的肝纤维化无创诊断技术,其原理是通过超声波测量剪切波在肝组织中的传播速度来推算其硬度。剪切波是低频声波,在组织中的传播速度为1~10 m/s,组织硬度越高,传播速度越快,传播速度可衡量组织的硬度。超声波为高频声波,在组织中的传播速度为1 500 m/s以上,超声波可以捕捉剪切波的传播过程,计算剪切波的传播速度,剪切波速度可转化计算成肝脏硬度值(LSM),以kPa为单位,从而判断肝纤维化程度,具有无创、无痛、快速、安全、易学、操作简便、重复性好、客观定量的特点。
目前临床常用的TE仪器包括FibroScan和FibroTouch,多项研究显示二者在评估肝纤维化程度效能上相关性良好,FibroTouch因其具备超声引导定位功能检测成功率较高,且采用动态宽频探头,无需为适应不同体型更换探头[23-24]。
TE在判断病情、决定治疗、随访疗效、评估预后等方面有重要作用[25-28]。2015年,欧洲肝病学会与拉丁美洲肝病学会《无创伤检查评估肝脏疾病严重程度及预后临床指南》指出:TE可作为低风险患者判定是否出现严重肝纤维化或肝硬化的首选方法,患者应定期行血清学标志物或TE检测用于肝纤维化进展的预后评估。脂肪性肝病患者可以借鉴[25]。但是,TE所测的LSM值会受多种因素影响,如肝脏炎症损伤[谷丙转氨酶(ALT)升高]、肝内外胆汁淤积[总胆红素(TBIL)升高]、肝脏水肿或淤血、肝淀粉样变性、脂肪变性、进食以及占位性病变引起的肝包膜张力增高等[25,29],对检测结果均会有影响。中重度脂肪肝可能导致LSM值虚高[30]。另外TE对于纤维化分期评价的准确性尚显不足,各期LSM临界值也有一定重叠。临床医生须熟悉TE检测的优缺点,最大限度地发挥其优势,避免其不足。
3.2.3 MRE MRE用来诊断肝纤维化的界值为2.93 kPa,预测的灵敏度为98%、特异度为99%。MRE可完整评估肝脏实质的病变,且不受肥胖、腹水的影响。MRE对纤维化分期(F2~F4)的受试者工作特征曲线下面积接近1,显著优于肝脏TE和声频辐射加压脉冲影像技术。缺点:其他原因如炎症、脂肪变、血管充血、胆汁淤积、门静脉高压等亦可导致肝僵硬度增加.从而使MRE评估纤维化受到干扰。此外,检查费用昂贵、设备要求高等限制性因素使MRE的普及程度不及TE[31-33]。
3.2.4 影像学检查 腹部超声(US)检查:操作简便、直观、无创性和价廉,US检查已成为肝脏检查最常用的重要方法。常用的B超是根据肝脏大小、边缘钝度、肝实质的粗糙程度、表面结节、肝动脉周围淋巴结大小、门静脉血流速度、脾脏大小等评估肝纤维化的程度,但超声检查诊断肝纤维化的特异度和灵敏度差异较大,也容易受到仪器设备、解剖部位及操作者的技术和经验等因素的影响。肝纤维化指数(FI=HARI/PVPV×100)是一个用于区分肝硬化与慢性肝炎的新的指数,公式中PVPV为门静脉峰值流速,HARI为肝动脉阻力指数。肝硬化患者的FI要高于慢性肝炎患者,3.6的临界值被认为是鉴别慢性肝炎与肝硬化的最佳值,准确率为96%。根据多普勒参数计算的FI是有前景的,尚需要对其进行验证[34]。
3.2.5 血清无创伤诊断模型 近年来,以肝组织学纤维化分期为基础,综合临床相关资料建立非创诊断模型已有较多的探索和报道,估计有30种左右血清无创伤诊断模型,但大多临床运用有一定的局限性,其特异性和敏感性均有较大差异,可参照进行验证性应用以积累更多的临床证据。目前常用的有:(1)APRI评分:谷草转氨酶(AST)和血小板(PLT)比率指数(APRI)可用于肝硬化的评估。成人APRI评分大于2分,预示患者已经发生肝硬化。APRI计算公式为[(AST/正常值上限)×100/PLT(×109/L)][35]。(2)FIB-4指数:基于ALT、AST、PLT和患者年龄的FIB-4指数可用于慢性乙型肝炎患者肝纤维化的诊断和分期。FIB-4=(年龄×AST)/(PLT×ALT的平方根)[36]。(3)FibroTest模型,是由法国学者建立,基于 2巨球蛋白、结合珠蛋白、 γ-谷氨酰转肽酶、TBIL和载脂蛋白A指标,并结合年龄和性别进行运算[37]。
评估血清无创伤诊断模型时需注意:(1)对轻度或重度进展性肝纤维化有其一定的预测价值;对于F2/F3的判别较差,大约45%~65%的受试者处于模型设置的两个界值之间的不确定值范围,难于判别中度肝纤维化分期;(2)存在假阳性和假阴性:标本错误,观察者差异;患者的年龄、炎症活动、溶血、胆汁淤积、脂肪肝、药物影响、BMI改变、饮食因素、肾功能衰竭及实验室检测的偏差等;(3)病因差异对标记组合的影响。
3.2.6 血清学标志物 常用的肝纤维化血清学标志物主要有:透明质酸(HA)、Ⅲ型前胶原(PCⅢ)及Ⅲ型前胶原肽或氨基端肽(PⅢP或PⅢNP)、Ⅳ型胶原(CⅣ)、层粘连蛋白(LN,国外缩写为LM),国内临床应用广泛。这些标志物均为ECM或其代谢产物,主要由HSC产生﹐代表不同的ECM代谢方面,如PⅢNP与PCⅢ倾向于反映胶原代谢的情况、HA反映肝纤维化活动及肝损伤、CⅣ反映基底膜的形成与破坏增加、而LN则反映基底膜转化,与门脉高压有一定关系[38]。血清学标志物的检测结果只能提示ECM代谢的异常,不能表示已沉积的肝纤维化程度,特异性受到肝细胞坏死及炎症影响,同时在一些内科疾病时,也可以出现纤维指标的升高,容易混淆判断。因此血清纤维化4项指标不是诊断肝纤维化程度的特异性指标[39]。这些标志物在肝炎不同的发展时期有不同的变化,其动态观察的临床意义远远大于单次的检测结果[40]。
理想的肝纤维化血清学标志物应具备以下条件:(1)对肝脏特异性高;(2)不受肝、肾和网状内皮细胞廓清的影响;(3)能反映ECM合成和降解的动力学平衡;(4)有助于诊断临床显著性肝纤维化并监视其进程和治疗反应;(5)易测定并具有良好的重复性。
3.2.7 其他 (1)基于超声技术的实时剪切波弹性成像又称二维剪切波弹性成像。操作者依照肝实质硬度图的颜色及定量数据(以kPa为单位),可直观、快速判断患者肝脏是否发生肝纤维化(≥F2期),并有望用于辅助临床评估抗病毒及抗纤维化治疗的疗效[25,41]。(2)声辐射力脉冲成像技术。成像技术不同于其他弹性技术,它不需要通过外部加压就能够评价深部组织弹性信息,其测量值为VTQ(Virtual touch quantification,以m/s为单位)弥补了常规超声成像方法的不足,且与肝活检的组织病理结果有较好的相关性。它还应用于评价脾脏、胰腺等组织弹性[42-43]。
3.3 诊断要点
3.3.1 慢性肝病病史 有慢性乙型肝炎、慢性丙型肝炎,寄生虫感染、酒精性肝病、非酒精性脂肪性肝病、肝豆状核变性、药物性或中毒性肝病、胆汁淤积与自身免疫性肝病等病史。病原学诊断参考中华医学会肝病学分会与感染病学分会制定的相关标准[44-49]。
3.3.2 临床表现 临床症状无特异性,可无症状或体征。除原发疾病临床表现外可有疲倦乏力、食欲不振、肝区不适或胀或痛、大便异常、舌质暗红或暗淡、舌下静脉曲张、脉弦细等。肝硬化患者还可有面色晦暗、蜘蛛痣、肝掌、脾脏肿大、舌有瘀斑等体征。
3.3.3 肝组织病理学检查 肝组织切片作苏木精-伊红染色、Masson三色染色、天狼猩红染色和(或)网状纤维染色,光镜下可观察到纤维组织不同程度的增生(F1~F4)。对于明确F4的患者,应结合临床,作胃镜检查,明确有无食管胃静脉曲张。
3.3.4 TE检查 参考我国《TE临床应用专家共识(2015年)》的建议[29],对于乙型肝炎病毒(HBV)感染者,通常在ALT及TBIL均正常的情况下,LSM 7~8.5 kPa可以确定为显著肝纤维化(F2)、排除及确诊肝硬化的临界值为11~14 kPa。对于丙型肝炎病毒(HCV)感染者,显著肝纤维化(≥F2)的LSM临界值定为7~8.5 kPa,肝硬化(F4)的LSM临界值为11~14 kPa;对于NAFLD,LSM≥9.8 kPa则考虑为进展性肝纤维化;对于酒精性肝病,LSM≥8.0 kPa诊断为进展性肝纤维化(F3),LSM≥12.5 kPa则诊断为肝硬化(F4);对于胆汁淤积性肝病,肝纤维化分别为≥F1、≥F2、≥F3及F4者,参考的LSM临界值分别为7.1~7.3 kPa、8.8 kPa、9.8~10.7 kPa及16.9~17.3 kPa。
3.3.5 影像学检查 腹部B超检查发现肝包膜粗糙,回声增密、增粗、增强且分布不均匀或呈网络状,血管走向不清等,或见门脉内径增宽、脾脏增厚等。应用超声实时剪切波弹性成像、声辐射力脉冲成像技术或MRE,可参照相应的技术标准。
3.3.6 实验室检查 肝功能异常或正常。
3.3.7 无创伤诊断模型 APRI、FIB-4、FibroTest等可异常升高,具体标准请参照相关文献。
3.3.8 诊断标准 临床上慢性肝病史患者如经肝组织病理检查确定纤维化程度在F2以上,即可确诊为肝纤维化;未行肝活组织检查的患者,可用无创伤诊断方法如血清无创伤诊断模型、TE检测LSM、MRE、超声实时剪切波弹性成像或ARFI达到肝脏纤维化硬度值,可确诊为肝纤维化;如不具备以上检查条件,肝脏B超声检查见肝包膜粗糙、回声增密增粗不均匀或呈网络状,血管显示欠清晰、门脉内径增宽、脾脏增厚等;肝功能生化检查正常或长期不稳定;血清纤维化标志物值异常升高等,高度怀疑肝纤维化。
推荐意见1 识别和定量肝纤维化动态评估是判断病情、决定治疗、随访疗效、评估预后的关键环节,具有非常重要的临床意义(A1)。
推荐意见2 肝活体组织病理学检查是不可替代的“金标准”,但属于有创检查、存在组织标本及读片者误差等缺陷,在评估时需注意(A1)。
推荐意见3 在资源有限的情况下,推荐使用APRI作为无创肝纤维化评估的首选检测;在有设备且经济条件允许的情况下,则推荐TE或Fibrotest作为无创肝纤维化评估的首选检测。TE比APRI和FIB-4两种血清学指标更准确(A2)。
推荐意见4 慢性乙型、丙型肝炎病情评估是患者管理和治疗决定所必须的步骤,在疾病治疗前无创肝纤维化分期是重要环节。在疾病治疗期和随访期中,无创肝纤维化和肝硬化动态评估能够判断疾病进展情况,并间接评估治疗应答。达到抗病毒治疗标准的患者、正在接受治疗的患者和停药随访患者,应该在治疗和随访期间接受疾病的监测,监测的频率为每半年一次(A1)。
推荐意见5 非酒精性脂肪性肝病患者评估肝脏有无炎症、进展性纤维化,是决定治疗、判断预后的关键。应常规行肝纤维化检测,尤其是合并代谢综合征、2型糖尿病等具有肝纤维化高危因素的患者;无创评估手段包括血清学标志物或TE可作为低风险患者判定是否出现严重肝纤维化或肝硬化的首选方法;非酒精性脂肪性肝病患者宜定期行血清学标志物或TE检测用于肝纤维化进展的预后评估,但须考虑中重度脂肪肝对LSM值虚高的影响(A1)。
推荐意见6 对于基线LSM较高或有共存疾病的患者,每半年复查TE可能有助于识别和治疗更具有侵袭性的疾病状态。如果LSM值随时间增加,可能提示肝纤维化或肝硬化患者预后差(A2)。
推荐意见7 不推荐单用肝纤维化血清学标志物及US检查来评估肝纤维化程度(A2)。
4.1 目标与策略 抗肝纤维化治疗的近期目标在于抑制肝纤维化进一步发展;远期目标在于逆转肝纤维化,改善患者的肝脏功能与结构,延缓肝硬化失代偿期的发生,减少肝癌的发生,改善生活质量,延长患者生存期。
肝纤维化是一主动进展与动态变化的复杂病理过程,涉及多个环节与因素,治疗策略上应针对肝纤维化形成和发展的各环节多点抑制,包括治疗原发病或去除致病因素、消除肝脏炎症、抑制胶原纤维形成、促进活化HSC的凋亡或转化回静止期状态、或直接促进纤维组织的降解等。这实际上是一种广义的抗肝纤维化综合疗法。其中,病因治疗是抗肝纤维化的首要对策,如长期有效抑制肝炎病毒复制、戒酒等可减轻肝脏持续损伤,从而促进纤维化肝组织的修复。慢性炎症反应是纤维化形成的前提,抑制炎症、促进肝损伤修复是抗肝纤维化的重要措施。而抑制肝脏ECM生成与沉积,促进其降解则是抗肝纤维化治疗的关键对策。有效抑制HBV复制或清除HCV可明显改善乙型或丙型肝炎患者的肝纤维化程度,部分患者可实现肝纤维化的逆转[50-51],但仍有部分即使取得良好病毒学和生化学应答的患者,其肝纤维化依然存在,甚至持续进展,最终发展为肝硬化或肝癌[51-53]。可见,病因治疗与抗炎治疗不等于、也不能完全替代针对ECM代谢与HSC活化的直接抗肝纤维化治疗,对于部分抗病毒治疗无效的患者,则更需要抗肝纤维化治疗。无论采用干扰素或是核苷(酸)类药物抗HBV联合扶正化瘀胶囊/片、复方鳖甲软肝片、安络化纤丸等抗肝纤维化药物治疗慢性乙型肝炎,临床观察到联合方案改善肝功能及肝纤维化指标的疗效均优于单用抗病毒药物[54-58]。
地址:重庆市渝北区宝环路420号重庆市卫生健康统计信息中心5楼《现代医药卫生》杂志 邮编:401120
电话:023-63853583、63621701 电子邮箱:xdyyws@vip.126.com、xdyyws@126.com